Artículo original publicado en PharmaManufacture.com
Los fabricantes de productos farmacéuticos pueden aplicar los estándares de sala limpia a los sistemas de aire comprimido para garantizar la calidad y seguridad de sus productos finales. A menudo se pasan por alto debido a la falta de regulaciones específicas, los sistemas de aire comprimido son críticos para muchos procesos en un ambiente de sala limpia. Las especificaciones de las salas limpias pueden aplicarse a los sistemas de aire comprimido e incluirse en los planes de control para garantizar la calidad durante todo el año.
Recomendaciones sobre la calidad del aire comprimido
La Guía de Buenas Prácticas de la Sociedad Internacional de Ingenieros Farmacéuticos (ISPE) recomienda, “en los casos en que el gas ingresa a un área clasificada, se requiere que al menos cumpla con los límites de clasificación de sala establecidos para el ambiente de sala limpia” (2016). Además, la guía más reciente de la FDA de EE. UU. Para productos farmacéuticos estériles de la industria producidos por procesamiento aséptico – Buenas prácticas de fabricación actuales recomienda que “el gas comprimido debe tener la pureza adecuada … y su calidad microbiológica y de partículas después de la filtración debe ser igual o mejor que la de el aire del entorno en el que se introduce el gas “.
Utilizando las recomendaciones de la FDA de EE. UU. Y la ISPE GPG, los fabricantes de productos farmacéuticos pueden evaluar adecuadamente la calidad de sus gases procesados, incluidos el nitrógeno, el oxígeno, el argón, el dióxido de carbono y el aire comprimido. Chad Larrabee, líder global de gestión de productos de Ingersoll Rand y copresidente de GPG: Process Gases, explica que el aire comprimido utilizado en los entornos de salas blancas debe coincidir con los niveles de calidad requeridos por esa sala (2019), según lo mencionado por la FDA.
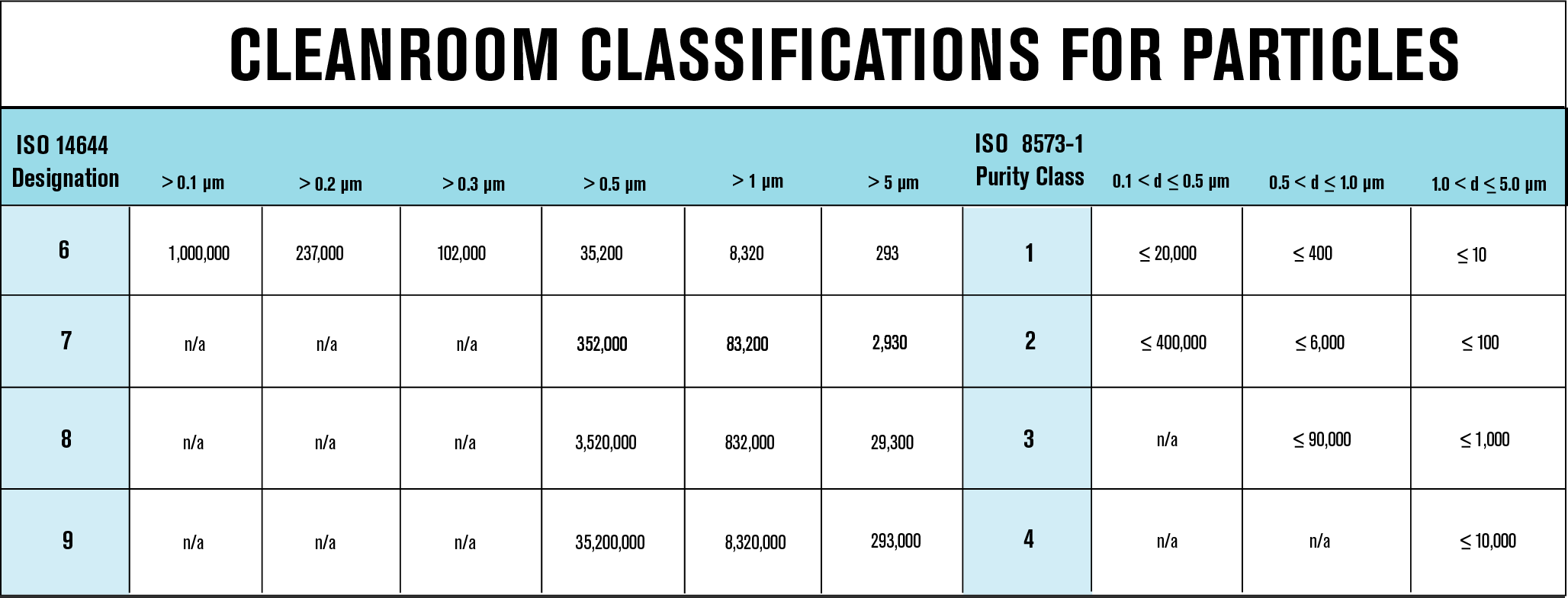
La norma de la Organización Internacional de Normalización (ISO), ISO 8573: 2010, se usa comúnmente para aplicaciones de aire comprimido en una variedad de industrias. Los fabricantes de productos farmacéuticos a menudo prefieren las especificaciones de sala limpia sobre ISO 8573-1 para adherirse a sus instalaciones de sala limpia. Para facilitar la comunicación entre fabricantes y distribuidores, las especificaciones ISO 8573-1 pueden traducirse en especificaciones para salas blancas. El siguiente cuadro muestra la comparación entre ambos estándares y cómo se pueden usar juntos para evitar confusiones.
Usos comunes del aire comprimido y los gases de proceso
Los gases de proceso y el aire comprimido se utilizan de diversas formas según el producto fabricado. El aire comprimido se puede utilizar en contacto directo con los productos para limpiarlos, airearlos o moverlos a través de los procesos. También se puede utilizar para embalaje. Los gases de proceso se pueden utilizar en bombas de fluidos que llevan productos a través de los procesos de producción y llenado. Los gases de proceso también pueden rociar o recubrir un producto, o actuar como un ingrediente del producto en sí.
Para identificar los riesgos de crear un plan de monitoreo, considere cómo se usa el aire o el gas comprimido, junto con la cantidad y el tipo de contacto que tienen con los productos.
Contaminación y Riesgos
Contaminantes comunes en gas de proceso o aire comprimido:
- Partículas (no viables)
- Agua
- Aceite
- Microorganismos (bacterias, levadura, moho)
Estos pueden poner en riesgo productos y sistemas y requieren pruebas periódicas.
Las cantidades de partículas en el aire ambiental o ambiental se pueden medir utilizando especificaciones de sala limpia. El aire comprimido se contamina al aspirar aire ambiental sin filtrar donde las partículas, el agua, el aceite y / o los microorganismos ingresan al sistema a través de la entrada.
Para evitar paradas o pérdida de ingresos y la confianza del consumidor, los fabricantes farmacéuticos pueden implementar una filtración adecuada, secadores desecantes y probar regularmente su aire comprimido con un laboratorio acreditado. Estos procedimientos pueden ayudar a los fabricantes a proteger sus productos y la reputación de su empresa.
Control y monitoreo de gases procesados y aire comprimido
Según Chad Larrabee, líder global de gestión de productos de Ingersoll Rand , la previsibilidad y la repetibilidad son los factores más importantes de cualquier plan de calidad en la fabricación farmacéutica. Por esta razón, es necesario diseñar un plan de monitoreo y muestreo que permita a las instalaciones detectar posibles problemas antes de dañar cualquier producto (Larrabee, 2019).
Una evaluación de riesgos creada por la instalación puede ayudar a determinar la frecuencia y las ubicaciones de los muestreos. Es importante que los fabricantes consideren los riesgos exclusivos de sus instalaciones. Los fabricantes pueden optar por realizar pruebas trimestrales para tener en cuenta los cambios estacionales, antes y después de realizar el mantenimiento, o anualmente. Las pruebas una vez al año satisfacen las recomendaciones estándar actuales, pero no proporcionan los datos necesarios para realizar un análisis de tendencias.
Ingersoll Rand proporciona sistemas de aire comprimido exentos de aceite certificados por TUV para la clase 0 según ISO 8573-1: 2010, lo que significa que el compresor no agrega aceite a la corriente de aire. Sin embargo, debido a que el aceite aún puede ingresar a la entrada del compresor a través de la atmósfera. Las pruebas periódicas con un laboratorio acreditado pueden ayudar a los fabricantes a garantizar que no hayan entrado contaminantes en el sistema de aire comprimido.
La Guía de Buenas Prácticas de la ISPE ofrece el siguiente cuadro como recomendación útil de muestreo utilizando las especificaciones de la sala limpia para los planes de aire comprimido por contaminante:

Cumplimiento de las especificaciones de las salas limpias para los sistemas de aire comprimido
Trabajar con un laboratorio acreditado puede garantizar que se satisfagan las necesidades individuales de muestreo y análisis de su instalación. Es fundamental que los fabricantes cumplan con las especificaciones de las salas blancas mediante la compra o alquiler de equipos específicos y que los informes de análisis se reciban de manera oportuna. Trace Analytics, LLC puede realizar pruebas con una amplia variedad de especificaciones, que incluyen ISO 8573-1, Guía de buenas prácticas de ISPE, Clasificaciones de salas blancas y especificaciones personalizadas, además de proporcionar análisis rápidos y confiables.










